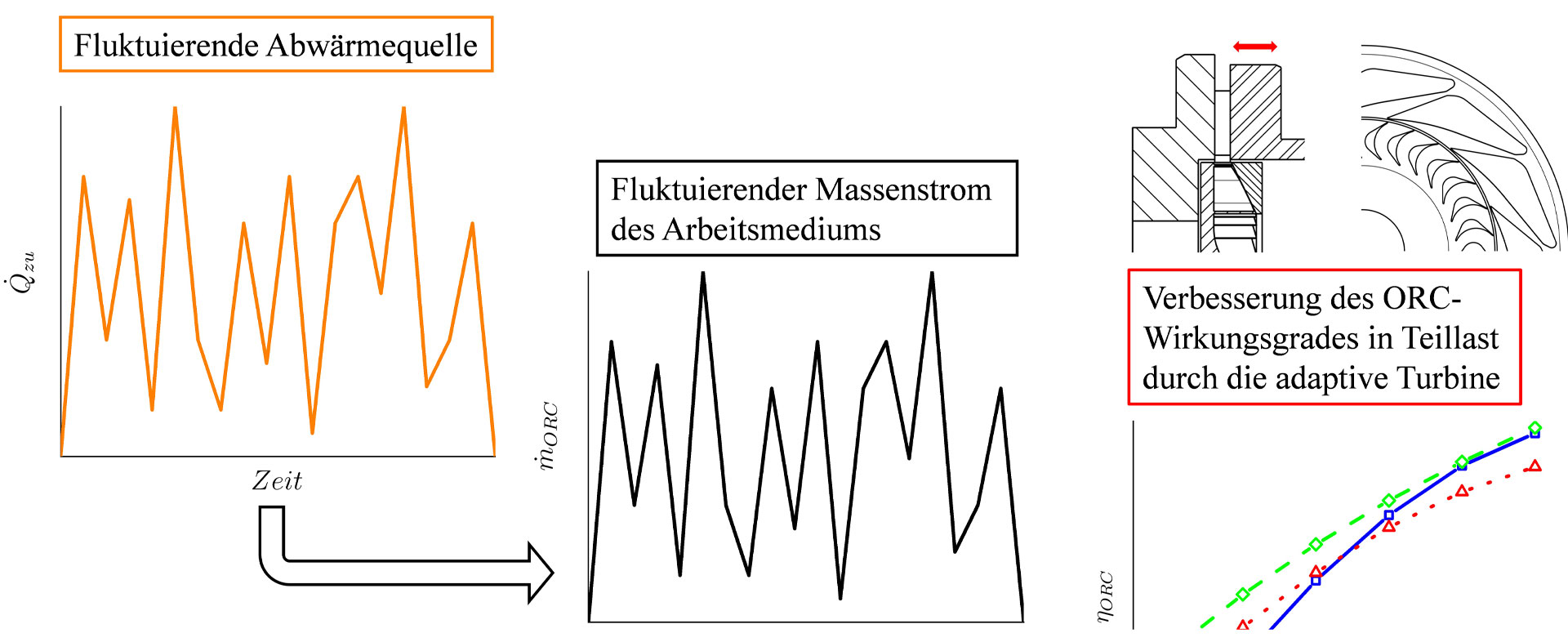
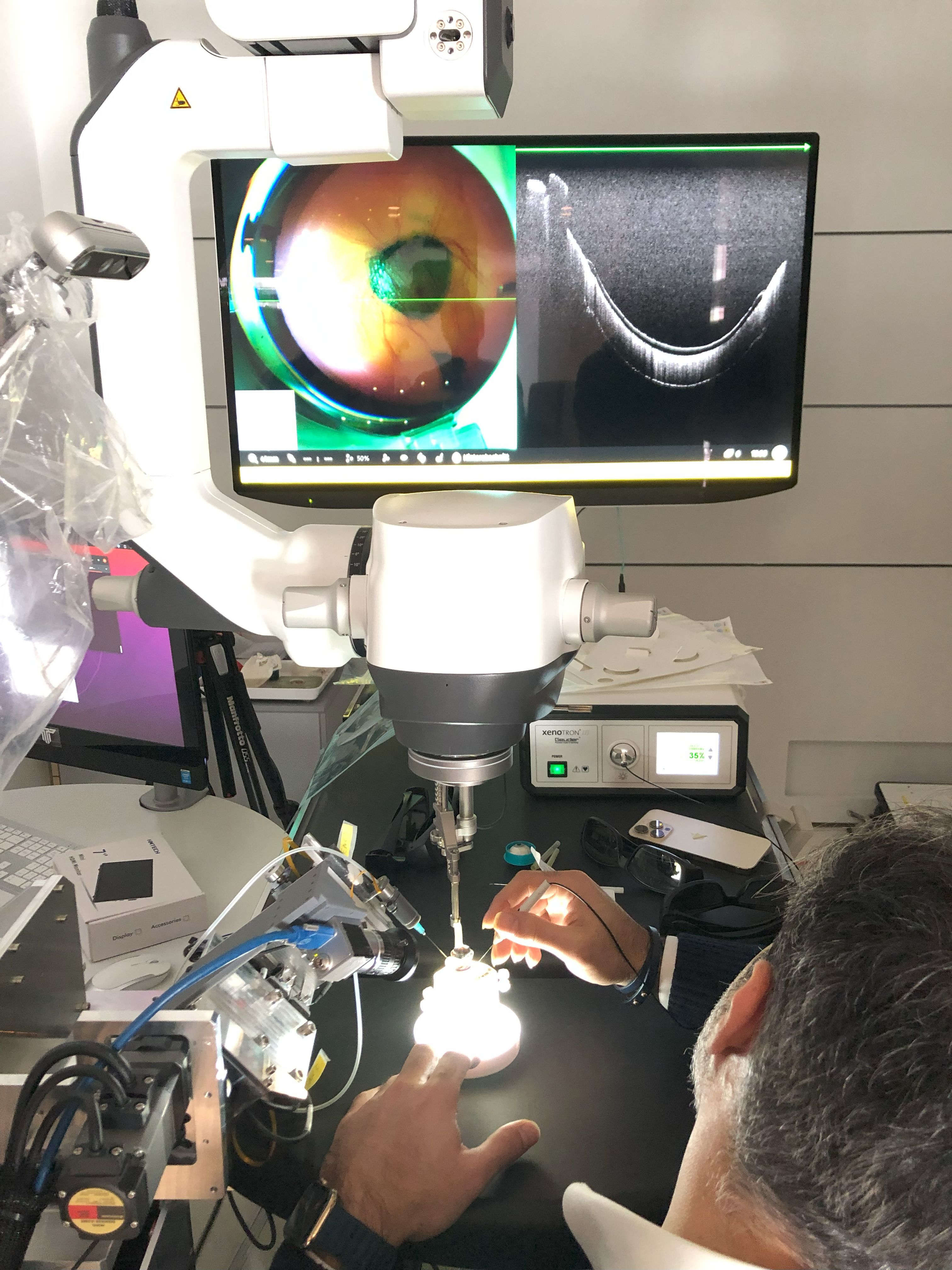
Eine Kernaufgabe in der Formulierung moderner Proteinarzneimittel ist die Vorhersage der Langzeitstabilität durch Extrapolation von Kurzzeitmessungen. Idealerweise sollte es möglich sein, aus der spontanen Denaturierung die Haltbarkeit verschiedener Rezepturen im Vergleich zueinander vorauszusagen. Gegenstand des Förderprojekts war, die Anwendbarkeit der mikroskaligen Thermophorese (MST) auf diese hochrelevante Fragestellung zu prüfen.
Ziel der Forschungsarbeiten war es, die mikroskalige Thermophorese (MST) mit bislang verfügbaren Methoden – wie Differential-Thermoanalyse (DSC), statische Lichtstreuung (SLS), differentielle intrinsische oder extrinsische Scanning-Fluorimetrie (DSF) – bezüglich Aussagekraft, Schnelligkeit, Materialverbrauch und Präzision zu vergleichen und bei erfolgversprechenden Ergebnissen optimierte Gerätekonfigurationen für den industriellen Einsatz zu konzipieren.
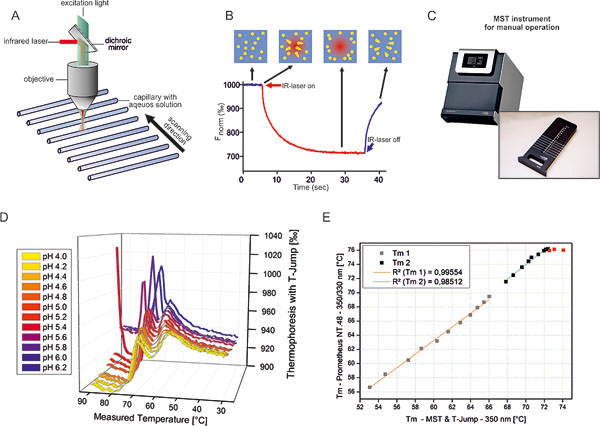
Strategisches Ziel war es, die der MST zugrunde liegenden physikalischen Messaufbauten in Zukunft nicht nur im Bereich der „drug discovery“, sondern auch im „drug development“ – bei der Entwicklung finaler Arzneiformen – anzuwenden.
Im Rahmen des Projekts wurden daher an verschiedenen Modellwirkstoffen (u. a. Antikörper und G-CSF) vergleichende Untersuchungen in verschiedenen pharmazeutischen Formulierungen ausgeführt. Dabei kamen neben der MST alle der oben genannten „Benchmark“-Methoden zu Einsatz. Außerdem wurde ein speziell für die Formulierungsentwicklung maßgeschneidertes, modifiziertes MST-Instrument angefertigt. Neben einem breiteren Temperaturbereich und einer höheren Präzision und Sensitivität wurde auch ein stärkerer IR-Laser implementiert, um neben den „klassischen“ Schmelzkurven auch rein Laser-induzierte Denaturierungs-/Aggregations-Experimente durchführen zu können.
Im Ergebnis konnte die MST erfolgreich in der Proteingalenik etabliert werden. Darüber hinaus wurden gegenüber dem bisherigen Industriestandard zur DSF schnellere und präzisere High-Throughput-Geräte entwickelt.