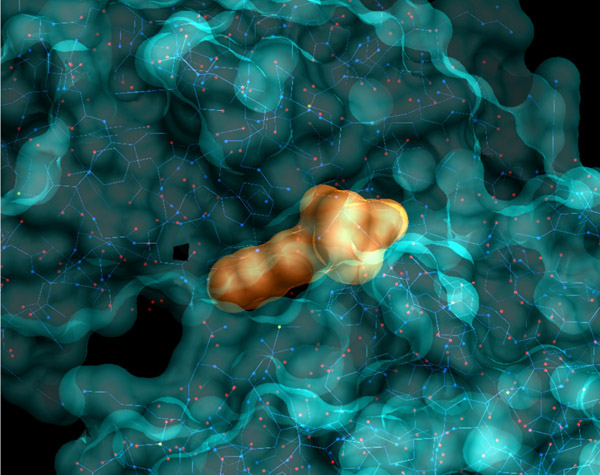
Hyaluronidasen sind in der Natur weit verbreitete Enzyme, die mit Hyaluronsäure ein wichtiges Biopolymer der extrazellulären Matrix abbauen. Sie wurden bislang als biologische Zielmoleküle in der Wirkstoffforschung vernachlässigt.
Hyaluronidasen begünstigen als „spreading factor“ beispielsweise die Ausbreitung von Krankheitserregern und Fremdstoffen im Gewebe. Sie werden zu den Virulenzfaktoren verschiedener Bakterien gerechnet, darunter A-Streptokokken, Pneumokokken und Staphylokokken. Beim Menschen gelten Hyal-1 und Hyal-2 als die wichtigsten Enzyme in somatischem Gewebe. PH-20 im Spermienkopf erleichtert die Penetration in die Eizelle und ist somit an der Befruchtung beteiligt. Die Enzyme und die Spaltprodukte der Hyaluronsäure stehen im Verdacht, Angiogenese und Metastasierung von Tumoren zu fördern. Für die weitere Aufklärung der (patho-) physiologischen Rolle der Hyaluronidasen werden potente und selektive Hemmstoffe als pharmakologische Werkzeuge benötigt. Solche Inhibitoren könnten als neue Arzneistoffe interessant sein, z. B. in der Behandlung von Tumoren und Arthrosen, zur Kontrazeption, zur Verbesserung der Wundheilung sowie in der antibakteriellen Therapie.
Ziel des Projektes war es, unter kombiniertem Einsatz virtueller und experimenteller Methoden „Arzneistoff-ähnliche“ Inhibitoren humaner und bakterieller Hyaluronidasen zu entwickeln, die sich zur Untersuchung des therapeutischen Potenzials eignen. Aktuelle Ligand- und Struktur-basierte Ansätze des computergestützten Wirkstoff-Designs sowie moderne Methoden der chemischen Synthese, der Prüfung der biologischen Aktivität und der multiparametrischen Optimierung wurden mit Erfolg angewendet. Mit diesen Technologien gelang es, neue Leitstrukturen für potente arzneistoffartige Inhibitoren bakterieller Hyaluronidasen zu identifizieren. Durch diesen „proof-of-concept“ und die methodischen Weiterentwicklungen wurden wesentliche Grundlagen für die erfolgreiche Übertragung der Strategie auf die humanen Enzyme geschaffen.