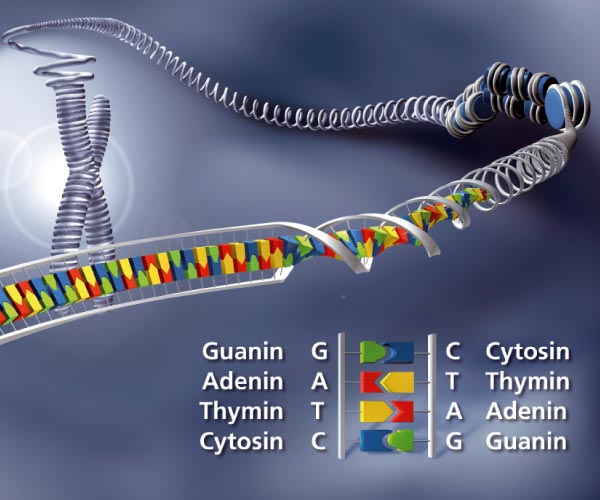
Schizophrenie hat eine erbliche Komponente. Wenn die Risikogene identifiziert werden können, lassen sich Prävention und Therapie entscheidend verbessern.
Etwa 800.000 Bundesbürger erkranken mindestens einmal im Leben an Schizophrenie, erstmals meist zwischen dem 18. und 35. Lebensjahr. Ca. 250.000 dieser Patienten sind bereits in jungen Jahren erwerbsunfähig. Damit wird Schizophrenie zur teuersten psychischen Erkrankung. Die jährlichen Kosten in Deutschland werden auf drei bis fünf Milliarden Euro geschätzt – und sind mit denen somatischer Volkskrankheiten wie Diabetes oder Herzerkrankungen vergleichbar.
Es gibt dabei viele Hinweise auf eine genetische Komponente: So erhöht sich das Morbiditätsrisiko von 1 % in der Allgemeinbevölkerung auf ca. 3–5 % bei Verwandten zweiten Grades oder Halbgeschwistern und auf 9–12 % bei Geschwistern und zweieiigen Zwillingen. Insgesamt weisen diese Daten auf eine Heritabilität, also die Möglichkeit einer Vererbung, von ca. 80 % hin. Diese Zahlen zeigen, dass die genetischen Risikofaktoren dringend identifiziert werden müssen.
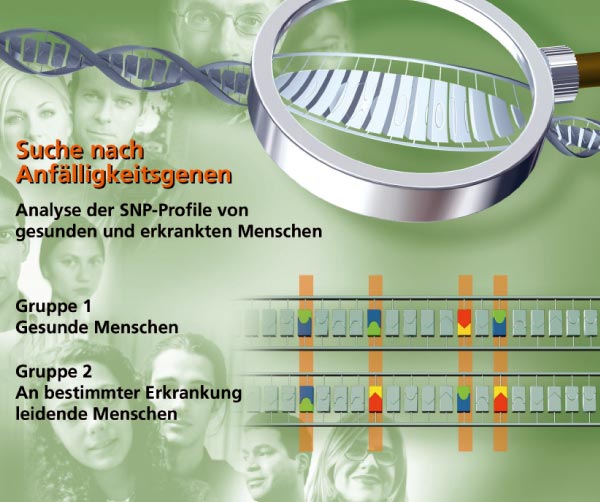
Schizophrenie ist jedoch eine komplexe, polygene Erkrankung, bei der jedes Risikogen für sich nur einen kleinen Effekt hat. Deshalb sollte ein aussagekräftiger Test eine Analyse möglichst vieler Risikogene beinhalten. In diesem Projekt sollen die Voraussetzungen für einen Gentest aus einem SNP-Portfolio abgeleitet und validiert werden. Grundlage dafür ist eine der weltweit besten Stichproben für Schizophreniegenetik. Die Genotypisierungsplattform (MALDI-TOF Massenspektrometrie) am Genetics Research Centre GRC erlaubt eine Hochdurchsatzanalyse großer Gruppen und eine individuelle Analyse. Die Kenntnis der genetischen Risikofaktoren kann nicht nur der Prävention und Diagnose dienen, sondern kann möglicherweise auch den Krankheitsverlauf voraussagen. Wichtig für die Therapie: Anhand genetischer Informationen hofft man voraussagen zu können, wie Patienten auf bestimmte Psychopharmaka ansprechen und welche Nebenwirkungen auftreten können.