Angesichts der aufkommenden Varianten von SARS-CoV-2 könnte ein mRNA-Impfstoff gegen hochkonservierte Regionen des Coronavirus-Genoms eine vielversprechende Lösung für Durchbruchinfektionen sein.
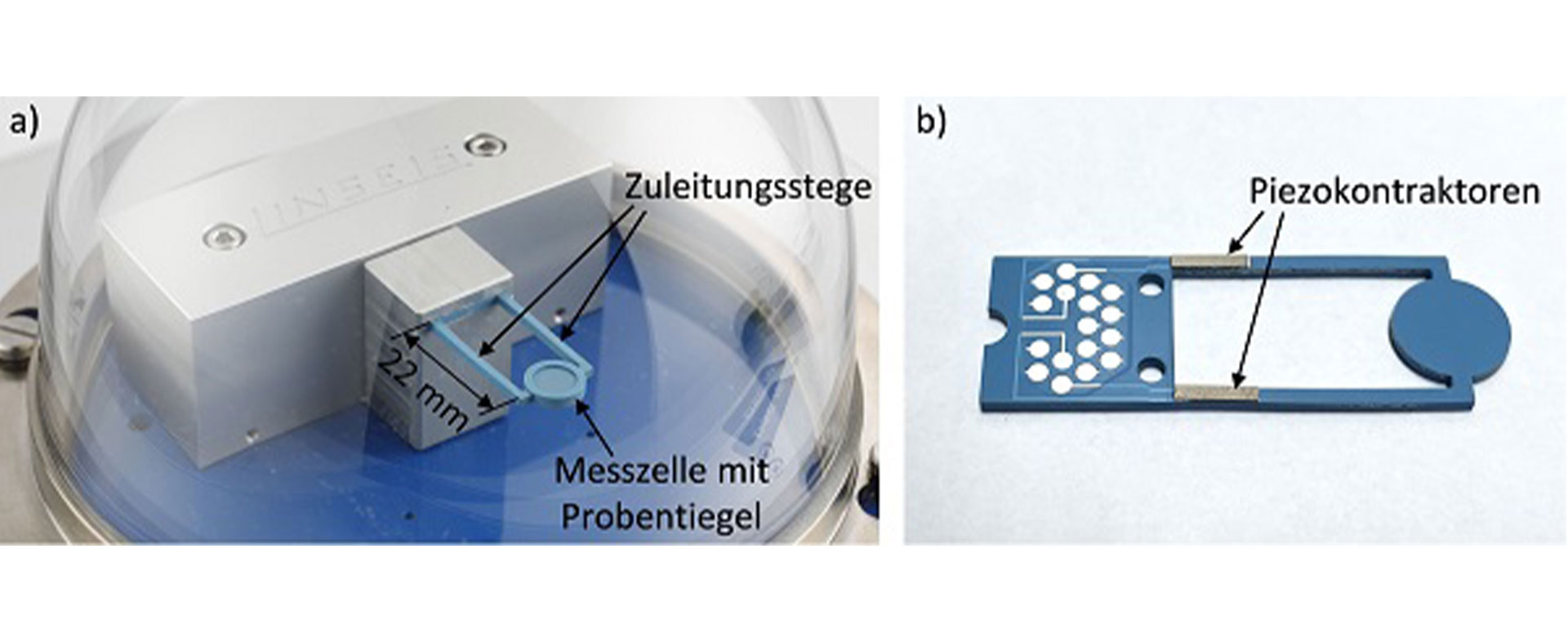
In diesem Projekt wurde ein Plasmid-Template für die In-vitro-Transkription einer mRNA-Sequenz entwickelt, die für die Rezeptor-Bindungsdomäne (RBD) des Spike-Proteins kodiert. Das mRNA-Capping wurde optimiert und die Produktion hochskaliert. Die Polymere für die Verkapselung und Polymerkonjugate wurden erfolgreich synthetisiert, und der mRNA-Ladeprozess wurde in einem mikrofluidischen Aufbau optimiert. Die entwickelte mRNA wurde in Polymermizellen formuliert, die mit Mannose oberflächenmodifiziert sind, um dendritische Zellen spezifisch zu adressieren.
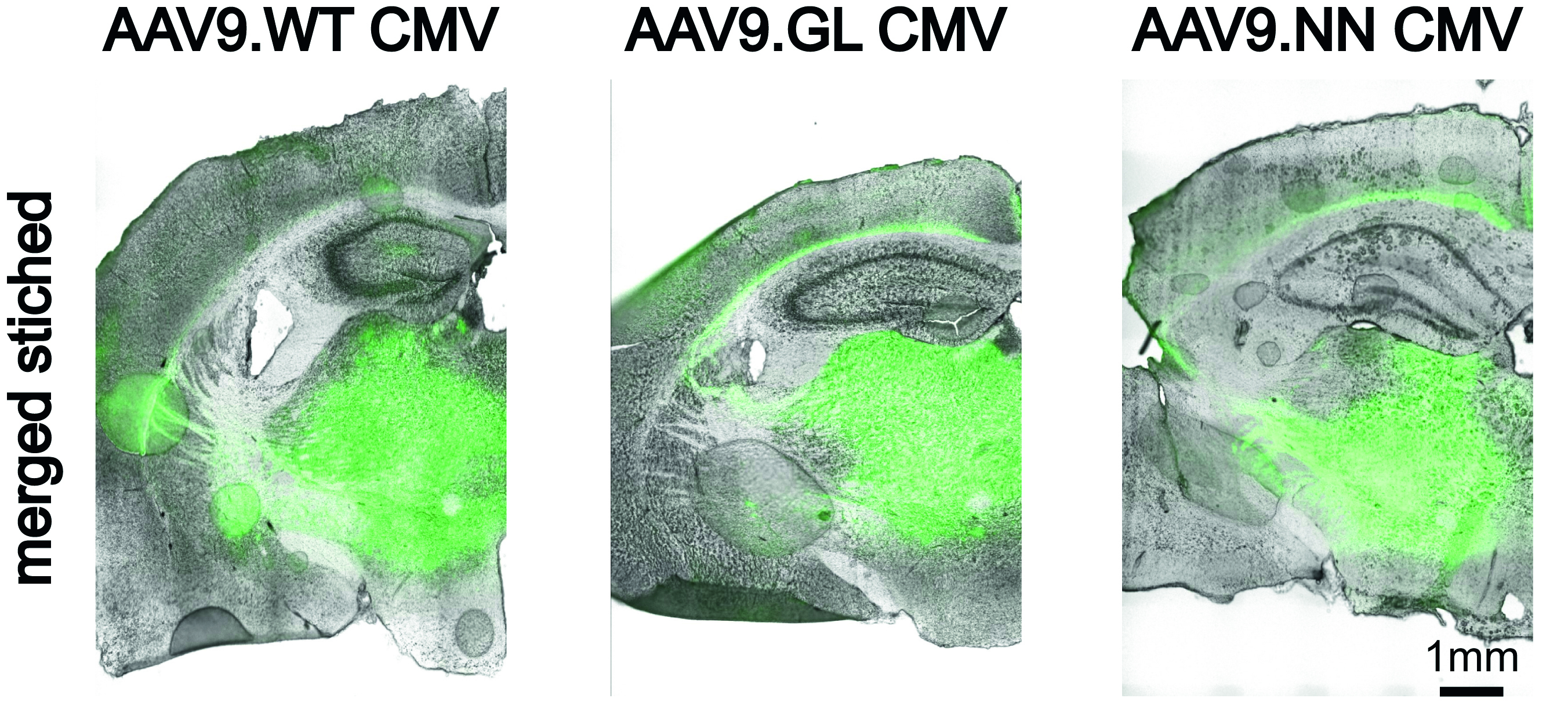
Die Ergebnisse bestätigten den Targeting-Vorteil von Mannose-modifizierten Mizellen in dendritischen Zellen sowie die transgene Expression und Aktivierung dendritischer Zellen für die anschließende MHC-Interaktion mit T-Zellen mit dem Endziel der Immunglobulinproduktion durch B-Zellen für eine effiziente Immunisierung.